چاپ سه بعدی قلب انسان با پرینتر سه بعدی
فرآیندهای چاپ سه بعدی قلب یا 3D Printing از نمونه سازی ساده با دستگاه های پرینتر سه بعدی برای اهداف بازرسی بصری به تولید محصول کاربردی تبدیل شده است که انعطاف پذیری، سفارشی سازی، مقیاس پذیری، قابلیت اطمینان، دوام و سرعت نسبتاً بالایی را ارائه میدهد. این فرایندها با کشف لایه های آزادی که قبلاً غیرقابل دسترسی بودند، مانند افزایش پیچیدگی طراحی، با موفقیت در زمینه زیست پزشکی به کار گرفته شد که حتی کاربرد آن به چاپ سه بعدی اجزای بدن انسان هم رسیده است، در ادامه به این مهم و شاید تا حدودی شگفت انگیز خواهیم پرداخت، با 3dRD تا انتها همراه باشید.
مقدمه پرینت سه بعدی قلب
چاپ زیستی برای اولین بار در سال 1988 با بارگذاری محلول زیستی متشکل از کالژن و فیبرونکتین در چاپگر جوهر افشان Packard-Hewlet که در بازار موجود بود، نشان داده شد. روش جوهر افشان با بارگذاری سلولها در یک کارتریج کار میکند به طوری که چاپگر زیستی ای سازمان یافته سلولها را به یک داربست/محیطی مانند هیدروژل رسوب میدهد. داربستها محل اتصال و مواد مغذی را برای تکثیر و بلوغ سلولها در بافت مورد نظر فراهم میکنند.
چاپ بیولوژیک جوهر افشان
چاپ بیولوژیکی جوهر افشان تا 50 میکرومتر وضوح دارد. با این حال، به عنوان یک سیستم مبتنی بر فشار، تراکم سلولی بسیار پایین کمتر از 106 سلول/ میلی لیتر را در خود جای میدهد. فناوری جوهر افشان علیرغم هزینه کم، سرعت چاپ بالا و زنده ماندن سلول در کاربرد محدود خود در ساختارهای پیچیده پر از سلول باقی میماند. توانایی ایجاد انواع ساختارهای دقیق که بافت بومی را تقلید میکنند برای کاربردهای بالینی ضروری است. با این حال، دستیابی به آن با فناوری جوهر افشان دشوار است.
چاپ با چندین پیوند زیستی
اخیراً، روشهایی مانند چاپ با چندین پیوند زیستی امکان ایجاد ساختارهای بافتی پیچیده با فناوری جوهر افشان رافراهم کرده است. برای مثال، دانشمندان یک شبکه ریزسیال غیر قابل هضم و قابل هضم با استفاده از دو پیوند زیستی ایجاد کردند. پیوند زیستی قابل هضم بر اساس آلژینات طراحی شده بود که توسط آلژینات لیاز طبقه بندی میشد در حالی که زیست پیوند غیرقابل هضم هنگام قرار گرفتن در معرض آنزیم دست نخورده باقی میماند. پس از چاپ لایه به لایه، جایی که زیستی قابل هضم در مکانهای اختصاص داده شده برای پرفیوژن و زیستی غیر قابل هضم برای قسمتهای اطراف استفاده شد، ساختار در معرض آلژینات لیاز قرار گرفت که راههای ریزسیال را ایجاد می کرد.
به منظور ذخیره سلولها در داخل الگوهای میکروسیالی، پیوند زیستی مبتنی بر آلژینات با سلولهای میزبان اصالح شد. پس از هضم آنزیمی، سلولها الگوهای چاپ شده را حفظ کردند و یک ساختار پیچیده پر از سلول را ترک کردند. مطالعاتی مانند این، امکان استفاده از فناوری جوهر افشان را برای کاربردهای پیچیده بالینی روشن میکند.
روش تحقیق پیرامون چاپ سه بعدی قلب انسان
فرایندهای پرینت سه بعدی از مدل های دیجیتالی به دست آمده با استفاده از نرم افزار مدلسازی سه بعدی یا داده های اسکن دیجیتال استفاده میکنند. مدلهای طراحی شده در نرم افزار طراحی به کمک رایانه CAD به فایل STL زبان تسمل استاندارد تبدیل میشوند تا اشیاء را در یک سیستم مختصات سه بعدی دکارتی، ذخیره اطالعات در مورد هندسه سطح اشیاء، بدون در نظر گرفتن رنگ، بافت و سایر موارد، تبدیل کنند.
اطلاعات مربوط به مدل مجازی برای تفسیر شدن توسط سخت افزار پرینتر سه بعدی به عنوان مثال، فایل STL ، بیشتر توسط یک نرم افزار برش ساز پردازش میشود تا یک فایل سازگار با ماشین فایل code g تولید شود. نرم افزار برش، اطالعات اضافی مخصوص ماشین را به داده های برش به دست آمده اضافه می کند.
استاندارد ISO/ASTM اصطالحات مورد استفاده در فناوری چاپگر سه بعدی را تعریف می کند و تکنیکهای مختلف چاپ سه بعدی را در هفت زیر گروه طبقه بندی می کند:
- اکستروژن مواد
- پرتاب مواد
- جت گیرنده
- فوتوپلیمریزاسیون مالیات
- همجوشی بستر پودر
- رسوب انرژی هدایت شده
- لمینت اجسام ورق
فرآیندهای چاپ زیستی از روشهای سنتی پرینت سه بعدی یا 3DP تکامل یافته است.

یافته های پیرامون چگونگی چاپ بیولوژیک با پرینتر سه بعدی زیستی
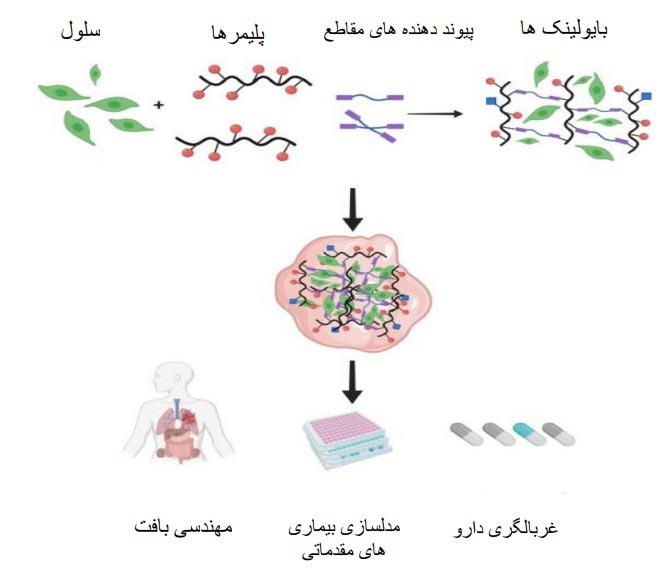
اصطلاح “بیوفابریکاسیون” به فرایندی منجر می شود که باعث ساخت محصول تعریف شده با عملکرد بیولوژیکی میشود. این تعریف کلی شامل فناوری هایی است که از سلول ها به عنوان بلوک های ساختمانی و مواد به عنوان سیمان برای ساختن سازه های سه بعدی 3D استفاده می کند. به این ترتیب، ساخت زیستی امکان ترکیب سلول ها را به صورت کنترل شده، برای ایجاد ساختارهایی که از بافتهای طبیعی تقلید می کنند، ایجاد میکند.
مونتاژ بافت های مصنوعی با پرینت سه بعدی زیستی
چاپ زیستی سه بعدی، که در بین روش های تولید زیستی گنجانده شده است، امکان مونتاژ بافتهای مصنوعی را با چاپ سوسپانسیون سلولها یا سنگدانه های سلولی در یک ماتریس خارج سلولی طبیعی یا مصنوعی فراهم می کند. در برخی روشها از جوهر استفاده می شود که از ترکیبی از مواد غیر زنده سازگار با مواد زنده و مواد زنده bioink ساخته شده است. پیوند زیستی با استفاده از ماشینهای کنترل کامپیوتری CNC در فضای سه بعدی ذخیره می شود تا معماری بافت را در مقیاس میکرومتری تولید کند.
تا کنون سه تکنیک اصلی بر اساس رسوب زیستی (پرینت زیستی) سلولی شده توسعه داده شده است:
- جوهر افشان
- لیزری
- اکستروژن
>> بیشتر بدانید: کاربرد پرینترهای سه بعدی در پزشکی
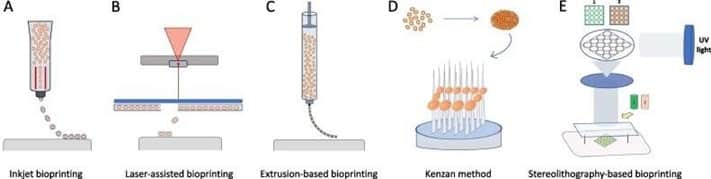
چاپ زیستی جوهر افشان، یکی از اولین رویکردهای تولید سازه های بیولوژیکی سه بعدی با چاپ از طریق نازل، از کارتریج های جوهر افشان و محرک های پیزوالکتریک استفاده می کند، که از برق برای کنترل دقیق حرکت استفاده می کنند، یا گرمایشهای گرمایی، بر اساس دما، برای بیرون ریختن قطرات میکرومتری زیستی. (شکل یک–A)
استفاده از چاپگرهای زیستی جوهر افشان ساده است، اما انتخاب زیستی به دلیل ویژگیهای رئولوژیکی آن، یعنی چگالی، ویسکوزیته و کشش سطحی محدود میشود. فقط می توان از پیوندهای زیستی با ویسکوزیته پایین برای جلوگیری از مشکالت انسداد استفاده کرد.
این امر امکان تنظیم چگالی سلولی و فرمول ماتریس ها را به شدت محدود میکند و چاپ زیستی جوهر افشان را برای اکثر برنامه ها نامناسب میکند. این محدودیت در روشهای رسوب گذاری بر اساس لیزر، که روشهای چاپ زیستی بدون نازل را نشان میدهند، دور میزند. چاپ زیستی با کمک لیزر LaBP از اسلاید اهدا کننده مسطح بارگذاری شده با زیستی و قلم لیزری استفاده می کند. (شکل1-B)
اسلاید اهدا کننده (به صورت وارونه نصب شده است) با یک لایه نازک جذب لیزر و یک لایه ضخیم تر حاوی سلولها و مواد زیستی برای چاپ پوشانده شده است. با متمرکز شدن لیزر روی لایه جذب کننده، حباب بخار تشکیل می شود و باعث بیرون راندن قطرات ریز میکرو متری از زیر لایه می شود. قطرات Bioink به صورت لایه به لایه روی لایه زیرین جمع کننده قرار میگیرند و اجازه میدهند الگوهای دلخواه و ساختارهای سه بعدی طبقه بندی شوند.
نقاط قوت Bio-ink
وضوح بالا و آزادی در فرمول bioink از مهمترین نقاط قوت LaBP است، در حالی که تهیه اسالید وقت گیر، هزینه های بالا و دسترسی کم برای کاربران عمومی از محدودیتهای مهم محسوب میشود. چاپ بیولوژیکی اکستروژن بر برخی از محدودیتهای روشهای رسوب گذاری فوق غلبه میکند و به محبوب ترین روش چاپ زیستی تبدیل شده است. این چاپگرهای زیستی زیستی را با استفاده از محرکهای پنوماتیک یا پیستونی از نازل خارج میکنند و رشته های سلوالری شده را با وضوح میکرومتری رسوب میکنند . (شکل C-1 )
رسوب میکروفیبر به ویژه برای تقلید بافتهایی با معماری طولانی یا تقارن استوانه ای مانند عروق خونی، لوبولهای کبدی، فیبرهای ماهیچه ای یا فاسیکولهای عصبی مناسب است. تکنیک های مختلفی برای القاء انتقال بیو پیوند از سول (پیش ساز بدون ژل، با رفتار مایع) به ژل (رفتار شبیه جامد) در حین چاپ زیستی اکستروژن ایجاد شده است.
یک امکان با چاپ مستقیم در حمام انعقاد، حاوی محلول اتصال عرضی که باعث ایجاد ژل زیستی میشود، ارائه می شود. به عنوان مثال، پیوندهای زیستی حاوی پلی ساکارید آلژینات، مشتق شده از دیواره های سلولی جلبک های قهوه ای، با پیوند عرضی یونی پس از اکستروژن در محلول کلرید کلسیم به سرعت ژل می شوند.
تکامل پرینت سه بعدی زیستی
تکامل اخیر چاپ زیستی مبتنی بر اکستروژن شامل اجرای نازل اکسترودر با دستگاههای ریزسیال است. در چاپ زیستی سه بعدی با محور چرخشی مرطوب، پیوند زیستی و محلول انعقاد به طور همزمان اکسترود میشوند. در نتیجه، انتقال سول ژل در نوک سر چاپ رخ می دهد و هیدروژل را با کنترل سریع و دقیق موقعیت مکانی خود توزیع میکند.
جدول
1- نقاط قوت و محدودیت های تکنیک های چاپ زیستی سه بعدی
| رویکرد | نقاط قوت | محدودیت |
| ساخت رشته های ذوب شده | ساخت سازه های متخلخل بالا | عدم استحکام مکانیکی
ناهمسانگردی در جهتZ ساخت در حالت مذاب ناسازگاری سلولها با گرمای حاصل از فرایند |
| سنگ استریولیتوگرافی(SL) | ساختار با وضوح بالا
دقت بالا زنده ماندن سلولها گرانروی نامحدود امکان حذف رزین پخته نشده محصول نهایی |
رویکرد آهسته
رزین غیر بیومیتیک اشعه ماوراء بنفش به عنوان منبع سرطان پوست عمل می کند نیاز به مقدار زیادی مواد عدم چاپ چند سلول زمان چاپ طولانی باعث کاهش ماندگاری سلول می شود |
| چاپ زیستی جوهر افشان | سهولت تعویض پیوندهای زیستی
سرعت ساخت سریع ماندگاری بالای سلول هزینه کم کیفیت بالا سازگار با مواد زنده و غیر زنده چاپ مواد زیستی ویسکوزیته پایین |
استفاده از مواد گرانروی بالا (mPa.S 10>)
نازل سر کوچک چاپ گرفتگی نازل به دلیل تراکم بالای سلول استحکام مکانیکی پایین ناتوانی سر چاپ در ایجاد جریان مداوم چگالی سلولی پایین دخالت تنش گرمایی و برشی |
| چاپ بیولوژیکی اکستروژن | طیف گسترده ای از مواد قابل چاپ
تجهیزات ارزان قیمت همه کاره و قابلیت سلولی بالا تراکم سلول بالا مناسب برای ساخت داربست یا کاشت در مهندسی بافت |
تنش برشی و تاثیر آن بر زنده ماندن سلولها |
| چاپ بیولوژیکی لیزر | وضوح بالا
دقیق رسوب زیستی در فاز جامد یا مایع در دسترس بودن استفاده از مواد چسبناک |
هزینه بالا
آسیب حرارتی ته نشینی گرانشی سلول ها در محلول زمان ساخت طولانی |
| پلیمریزاسیون مالیات بر ارزش افزوده | کیفیت بالا
پردازش سریع |
اثر سمیت سلولی آغازگرهای نوری
محدود پلیمرهای حساس به نور |
| چاپ زیستی مغناطیسی | چاپ سریع چندین بافت
کنترل فضایی خوب مستقل از بستر پروتئینی مصنوعی |
وابسته به میدان مغناطیسی دقیق |
| چاپ زیستی آکوستیک | تکنیک بدون نازل
عدم وجود گرما و تنش برشی تکنیک ارتباط رایگان |
ضعف در تشکیل سلول بیومیمتیک لادن |
| کشت زیستی | ساخت چند سلولی | مواد چسبناک بالا
پشتیبانی از سلول |
مواد زیستی متداول در چاپ زیستی سه بعدی

در کنار تنوع در فناوری چاپ زیستی سه بعدی، انتخاب مواد زیستی به کاربرد محصول نهایی مربوط می شود. به عنوان مثال، موارد مصرف شده در کاربردهای دندانپزشکی باید دارای میزان تجزیه بیولوژیکی طولانی و مقاومت مکانیکی بالایی باشد.
>> بیشتر بدانید: چاپ سه بعدی بافت نانو
-
پلیمرهای مصنوعی
زیست سازگاری، یکنواختی در تخریب و قابلیت چاپ از عوامل مهم برای مواد زیستی با کاربرد در چاپ زیستی سه بعدی هستند. به طور کلی، مواد زیستی ،طبیعی و/یا مصنوعی (در دستگاه های بیولوژیکی) هستند که برای ترمیم یا حتی جایگزینی هر اندام بدن استفاده می شوند.
با تکیه بر ماهیت شیمیایی آنها، آنها در چهار گروه فلزات، پلیمرها، سرامیک ها و کامپوزیت ها طبقه بندی می شوند. فلزات دارای استحکام مکانیکی بالا و کامپوزیت یا سرامیک هستند، در حالی که مقاومت خوردگی سرامیک ها و کامپوزیت ها در مقایسه با سایر گروههای مواد بیشتر است. قابل ذکر است که پلیمرها در مقایسه با بقیه، زیست سازگار و تجزیه پذیر هستند.
-
بایو اینک ها
اصطلاح جوهرزیستی یک موضوع مهم در چاپ زیستی اندام ها و صنعت بافت است. پیوندهای زیستی شامل مواد زیستی و سلولهای زنده در محیط ماتریس سلولی است .در مقایسه با مواد پرینت سه بعدی سنتی، پیوندهای زیستی باید دارای اجزای زیستی غیر سمی و همچنین دمای چاپ زیر دمای فیزیولوژیکی باشند.
با توجه به مطبوعات، پیوندهای زیستی بر اساس نقش آنها به چهار گروه اصلی طبقه بندی می شوند:
- عملکردی
- فانی
- پشتیبانی
- ساختاری
به دلیل مواد کاربردی موجود در پیوندهای زیستی، هر دو پلیمرهای طبیعی و مصنوعی در این زمینه استفاده می شود .
پلیمرهای مصنوعی شامل پلی کاپرولاکتون (PCL)، پلورونیک، پلی وینیل پیرولیدون (PVP) ، پلی اتیلن گلیکول (PEG) و همچنین پلیمرهای طبیعی مانند ژلاتین، اسید هیالورونیک، کلاژن و ماتریژل هستند. انواع مواد در پیوندهای زیستی برای اجرای ساختارهای چاپ سه بعدی مانند پلیمر، الاستومر، سرامیک یا هیدروژل استفاده می شود. این بخش نقاط قوت و محدودیت های این مواد را در چاپ زیستی سه بعدی شرح می دهد.
جدول 2
خلاصه پلیمرهای مصنوعی رایج در کاربرد چاپ زیستی سه بعدی
| تکنیک چاپ زیستی | پلیمر | ویژگی های اصلی | تصویر |
| چاپ زیستی جوهر افشان | PEG | به عنوان چاپ زیستی استفاده می شود
مدول کشش قابل قبول قابلیت اتصال به فتوکراس محلول در آب |
 |
| PEGهیدروژل | قابلیت تشکیل هیدروژل
کاهش ویسکوزیته هیدروژل |
 |
|
| FDM | ABS, PLA | سازگار با زیست محیطی
نقطه ذوب مناسب کاربرد در مهندسی بافت |
 |
| بر اساس اکستروژن | PLA/HA | استحکام مکانیکی بالا
مدول الاستیک بالا |
 |
| آلژینات/PCL | تعمیر و نگهداری در ساختار داربست |  |
|
| PCL/HA | افزایش فعالیت زیستی |  |
|
| PEG/PCL | افزایش رشد سلولی
محدود کردن کانی سازی بافت |
 |
ساختار قلب
قلب پستانداران یک عضو شگفت انگیز است که به طور متوسط در هر دقیقه 70 بار یا 2 تا 3 میلیارد بار در طول عمر یک فرد میتپد، با فرض طول عمر متوسط 75 سال. از نظر آناتومیکی، قلب پستانداران شامل چهار اتاق، بطن چپ و راست و دهلیز 23،22 است (شکل 3). علاوه بر این، جریان خون در قلب پستانداران توسط چهار دریچه، دو دریچه دهلیزی – بطنی، دریچه آئورت و دریچه ریوی تنظیم می شود. قلب پستانداران از عروق بسیار پیچیده تشکیل شده است که شامل گردش عروق کرونر، رگهای بزرگتر است که جریان خون را در داخل/خارج از قلب انجام میدهد و میکروسیرکولاسیون که خون را به قلب می رساند.
تعادل
تعادل پیچیده بین امواج دپلاریزاسیون الکتریکی و انقباضات همزمان بافت ماهیچههای قلب منجر به تحویل بسیار دقیق خون اکسیژن دار از طریق آئورت به کل بدن میشود. سیستم الکتریکی قلب شامل گره سینوسی (SAN) ، گره دهلیزی بطنی (AVN)، شاخه بسته نرم افزاری چپ و راست و شبکه وسیعی از سلولهای پورکینژ است. امواج دپلاریزاسیون خود به خود در گره SAN آغاز میشود، از طریق AVN حرکت میکند و از طریق شبکه پیچیده ای از الیاف پورکینژ در سراسر قلب توزیع می شود.
جفت شدن امواج دپلاریزاسیون الکتریکی با انقباض عضله قلب
دپلاریزاسیون کاردیومیوسیتها منجر به افزایش گذرای کلسیم درون سلولی میشود که به نوبه خود مجموعهای پیچیده از رویدادهای مولکولی را که منجر به انقباض ماهیچه ها میشود، ایجاد میکند. این به عنوان جفت شدن E-C یا جفت شدن امواج دپلاریزاسیون الکتریکی با انقباض عضله قلب شناخته میشود . تغییرات فضایی در ماتریس خارج سلولی عملکرد مناسب هر یک از اجزای قلب را تضمین میکند.
یک سوال مهم در مهندسی زیستی کل قلب ایجاد میشود:
چگونه می توان توزیع فضایی سلولها را به مهندسین زیستی از نظر آناتومیکی و عملکرد قلب تنظیم کرد؟
پرینت زیستی سه بعدی علاوه بر تنظیم فضایی سلولها ،قرار دادن دقیق مواد زیستی را نیز امکان پذیر میکند.
در اینجاست که پرینت زیستی سه بعدی یک ابزار قدرتمند را ارائه میدهد که به ما امکان میدهد انواع مختلف سلولها را به طور دقیق در یک الگوی خاص قرار دهیم، در نتیجه امکان کنترل دقیق بر فرایند مهندسی زیستی قلب را فراهم می کند.
این امر در مورد سایر فرآیندهای تولید بافت و اندام صدق میکند، جایی که چاپ زیستی سه بعدی ابزاری قدرتمند برای تنظیم مکانی انواع سلولهای مختلف در مکانهای آناتومیکی بسیار خاص است.
>> بیشتر بدانید: چاپ پای مصنوعی با پرینتر سه بعدی
چاپ سه بعدی بافت قلب توسط پرینتر سه بعدی
چاپ زیستی اندامی به پیچیدگی قلب انسان تا همین اواخر به عنوان علمی تخیلی تلقی میشد. با این حال، پیشرفتهای زیادی در زمینه ساخت بافت و اندام صورت گرفته است، که مسیر روشنی را برای چاپ زیستی قلب انسان ها فراهم می کند، زمینهای که از داستان علمی تخیلی به واقعیت تبدیل شده است. این امر با انتشار اخیر در آوریل 2019، که توانایی چاپ زیستی قلبها را نشان می دهد، نشان داده شد. در حالی که این کار توانایی چاپ مجدد یک ساختار سه بعدی شبیه قلب انسان را به نمایش گذاشت، هیچگونه نمایش واضح و قانع کنندهای از عملکرد اجرایی یا دادههای بافت شناسی قوی که سازمان و جهت گیری سلولهای پستانداران را نشان دهد، وجود نداشت.
پلن پرینت سه بعدی زیستی برای قلب انسان
نقشه راه برای چاپ زیستی قلب انسان در شکل 6 ارائه شده است .MRI های بیمار برای تهیه یک نقشه سه بعدی کامل از قلب انسان، که مخصوص بیمار است، استفاده می شود. بیوپسی پوست از بیمار گرفته می شود و فیبروبلاستهای پوستی جدا شده و به سلولهای بنیادی پرتوان القایی (iPS) ، سلولهای بنیادی که قابلیت تبدیل به همه انواع سلولهای بدن انسان را دارند، تبدیل میشود .این سلول های iPS سپس برنامه ریزی مجدد میشوند تا کاردیومیوسیتهای منقبض کننده را تشکیل دهند.
در حالت ایده آل، سلولهای iPS نیز برنامه ریزی مجدد میشوند تا سلولهای رسانا و پورکنژ و سلولهای سیستم عروقی را تشکیل دهند، از جمله سلولهای عضلات صاف، سلولهای اندوتلیال و فیبروبلاستهای قلبی. سپس سلولهای باز برنامه ریزی شده با پیوندهای زیستی فرموله شده سفارشی ترکیب میشوند که برای انواع مختلف سلولها متفاوت است و برای چاپ مجدد قلب های خاص بیماران استفاده می شود. پیوندهای زیستی شامل فرمولهای سفارشی از مواد زیستی، افزودنیها، عوامل رشد و هورمونها است.
بعد از چاپ، قلبها برای چند روز تحت شرایط ساکن کشت داده می شوند و پس از آن با کشت و تنظیم بیوراکتور برای حمایت از رشد و بلوغ ماهیچه های قلبی مورد استفاده قرار میگیرد.
فرایندهای پس از چاپ قلب
پس از تهویه بیوراکتور، قلبهای چاپ شده زیستی آماده پیوند بالینی هستند .حسگرهای سفارشی برای اندازه گیری زنده ماندن سلول و بافت و عملکرد اجرایی برای ثبت معیارهایی مانند فشار بطن چپ و ویژگی های الکتروکاردیوگرام استفاده می-شود. از آنجایی که قلب با استفاده از سلولهای بیمار اتولوگ به صورت زیستی چاپ شد، قلبهای چاپ شده زیستی مقاوم در برابر ایمنی هستند و بیمار به هیچگونه درمان سرکوب ایمنی نیاز ندارد.
توانایی ایجاد یک گردش خون میکروواسکولار کاملاً کاربردی در بافتهای زیستی یکی از مهمترین چالشهای موجود در این زمینه است. فناوری چاپ زیستی با توانایی ایجاد یک عروق میکروواسکولار به طرزی منحصر به فرد به این چالش پرداخته است. فن آوریهای دیگر مانند سلول زدایی کل اندام به طور متفاوتی با این مشکل مقابله کرده و از عروق موجود برای پرفیوژن اندام استفاده کرده اند.
مهندسی مجدد سیستم هدایت قلب
جنبه مهم دیگر توانایی مهندسی مجدد سیستم هدایت قلب است، که یک سیستم بسیار ظریف و پیچیده است که برای توزیع امواج دپلاریزاسیون همزمان در سراسر قلب طراحی شده است .SAN شامل مجموعه ای از سلولهای ضربان ساز تخصصی است که در محل اتصال ورید اجوف فوقانی با دهلیز راست قرار دارند و مسئول ایجاد فعالیت ضربان ساز خود به خود قلب است .تکانه های الکتریکی تولید شده در گره SAN از طریق AVN از طریق بسته نرم افزاری این، و بافت بطنی در سراسر از طریق الیاف تخصصی پورکینژ .در حالی که سیستم هدایت قلبی پیچیده است، SANرا می توان به عنوان نقطه شروع فعالیت الکتریکی در نظر گرفت، در حالی که الیاف پورکنژ تا حد زیادی مسئول انتقال فعالیت الکتریکی از طریق بافت بطنی هستند که منجر به انقباض عضله قلب میشود.
آریتمیهای دهلیزی و بطنی یک مشکل بالینی قابل توجه در بیماران مبتلا به نارسایی قلبی است. در حالی که برخی از درمانهای دارویی موثر و همچنین تکنیکهای فرسایش تهاجمی وجود دارد، کنترل این آریتمیها اغلب دشوار است.
رویکردهای مبتنی بر داروهای سلولی و احیا کننده برای درمان آریتمیها در مراحل ابتدایی باقی میمانند و شواهدی مبنی بر ترمیم هدایت طبیعی مبتنی بر سلول با ترمیم احتمالی ریتم سینوسی وجود دارد.
استفاده از فناوری پرینتر سه بعدی زیستی سه بعدی به احتمال زیاد تأثیر کمی در درمان مستقیم آریتمیها خواهد داشت به استثنای این که بتوانیم سلولهای جدید خودپلاز کننده خود به خودی را کاشت کنیم. از سوی دیگر، مدل های میکروفیزیولوژیکی سه بعدی بافت قلب که شامل سیستمهای هدایت چاپ شده یا سلولهای مشتق شده از بیماران با استعداد ژنتیکی به آریتمی است، مدلهای مهم آزمایشگاهی را پشتیبانی می کند که از توسعه داروهای موثر ضد آریتمی پشتیبانی میکند.
ماهیچه قلبی
پنجمین جزء کل قلب ساخته شده، ماهیچه قلبی است که نقش اصلی آن در ایجاد انقباض و پر شدن حفره های قلب است. جستجو برای یک منبع اتولوگ از کاردیومیوسیتها همچنان در حال بررسی شدید است و مطمئناً از درک جدیدی از تمایز سلولی سود خواهد برد. فناوری سلولهای بنیادی پرتوان القایی نویدبخش ارائه کاردیومیوسیتهای اتولوگ مشتق شده از سلولهای پیش ساز خود بیمار است سیستمهای میکروفیزیولوژیکی سه بعدی با استفاده از کاردیومیوسیتهای مشتق از سلولهای بنیادی مشتق از بیماران مبتلا به انواع کاردیومیوپاتی در حال توسعه است. سازههای بافتی یا جمعیتهای مخلوط سلول ها از جمله کاردیومیوسیتها و سلول های عروقی نویدبخش کشف دارو است.
در طول مونتاژ کل قلب زیستی، فرآیند چاپ زیستی سه بعدی به احتمال زیاد محل قرار گیری کاردیومیوسیتها با جهت گیری فضایی خاص، میکروسیرکولاسیون و عناصر رسانایی الکتریکی را ادغام می کند. پیش بینی می شود که این بافت بافت قلبی با مجرای عروقی ماکرو هم ادغام شود که هم پرفیوژن شریانی و هم بازگشت وریدی را فراهم می کند. ما یک سیستم میکرو عروقی و ماکروواسکولار را در ساختاری که به عنوان محفظه پویا پرفیوژن (DIP) تعریف می کنیم، مونتاژ کرده ایم . این مبنایی برای یک سیستم عروقی قابل جراحی است که در نهایت با استفاده از چاپ زیستی سه بعدی شامل کاردیومیوسیتها مونتاژ می شود.
اهداف بالینی نسل بعدی چاپ سه بعدی قلب
اهداف بالینی برای نسل بعدی بافت قلب با چاپ سه بعدی شامل بیماران اطفال و بویژه آن دسته از بیماران با نقایص مادرزادی است که باعث می شود بافت کافی برای بازسازی قلب وجود نداشته باشد. مزیت قابل توجه سازه های بافتی چاپ زیستی، توانایی این سازهها برای رشد با کودک خواهد بود. به طور واضح، هنوز مشخص نیست که چگونه این بافتهای پیچیده قلب با چاپ زیستی و کاشته شده سه بعدی رشد کرده و با سیگنال های فیزیولوژیکی تنظیم کننده رشد و بلوغ طبیعی اندام ها سازگار می شوند. مطالعات روی رگهای خونی مهندسی شده که به عنوان جایگزین شریان ریوی کاشته شده اند نشان می دهد که عروق بالغ شده و همچنان با بیماران رشد میکنند.
هر فناوری جدیدی باید قبل از پذیرش به طور کامل تأیید شود و چاپ سه بعدی و چاپ زیستی برای کاربردهای پزشکی نیز از این قاعده مستثنی نیست. با این حال، مفهوم چاپ مدل قلب برای کمک به ارزیابی بیماری و کمک به مداخله مناسب به واقعیت تبدیل شده است. این قابلیت جدید سوالات جدیدی را در مورد اینکه چگونه این امر باید به سرعت وارد عمل بالینی شود به ارمغان می آورد.
تمام اجزای فرآیند چاپ سه بعدی از بدست آوردن تصویر تا دقت چاپ نهایی مورد بررسی قرار می گیرند. هزینه کل این فرآیند ارزیابی می شود. چاپ بیولوژیکی سه بعدی نیاز به بررسی بیشتری دارد زیرا محصول نهایی باید اثربخشی و دوام متناسب با بافت جایگزین شده را ارائه دهد. این فرصت از همه این چالشها ناشی می شود که ممکن است در آینده بتوانیم یک چاپگر زیستی سه بعدی را برای مونتاژ بخشی از قلب یا حتی کل قلب ساخته شده بر اساس طرح هایی که نقایص موجود در قلب انسان که منجر به نارسایی قلبی می شود را برطرف می کنند، برنامه ریزی کنیم.
راه منطقی برای چاپ زیستی
ما راهی واضح و منطقی برای چاپ زیستی قلب انسان و همچنین چالشهای کلیدی علمی و فناوری ارائه کرده ایم که زمینه را به این نقطه منتقل کرده است. طی چند سال گذشته پیشرفتهای زیادی صورت گرفته است، و اکنون مشخص است که قلبهای چاپ سه بعدی زیستی برای پیوند بالینی یک واقعیت کوتاه مدت هستند .با این حال، مانند هر تلاش علمی، زمینه چاپ زیستی سه بعدی قلب انسان نیز خالی از چالش نیست. مهم ترین چالشی که باید در این زمینه بر آن غلبه کرد و به طور کلی زمینه درمان سلولهای بنیادی قلب را متزلزل می کند، عدم بلوغ کاردیومیوسیتهای برنامه ریزی شده مجدد است.
تبدیل سلولی
تبدیل سلول های iPS به کاردیومیوسیتها در حال حاضر استاندارد و قابل تکرار است، سلولهای تمایز یافته شبیه یک فنوتیپ جنینی هستند و هدایت این سلولها به یک فنوتیپ بالغ همچنان یک چالش مهم در زمینه درمان سلولهای بنیادی قلبی است.
یک نشریه اخیر به این چالش پرداخته و نشان داد که تحریک الکترومکانیکی همراه با کاردیومیوسیتها که از سلولهای iPS برنامهریزی شدهاند نشانگرهای فنوتیپ بالغ را نشان میدهد، از جمله وجود شبکه آندوپلاسمی خوب سازمان یافته و شبکه سارکوپلاسمی. در حالی که این کار نیاز مشخصی را در زمینه درمان با سلولهای بنیادی قلب و چاپ سه بعدی قلب انسان برطرف میکند، هنوز در آزمایشگاههای دیگر تکثیر نمیشود، عمدتا به دلیل استفاده از بیوراکتورهای تخصصی برای تحریک الکترومکانیکی مورد استفاده در مطالعه منتشر شده.
پس از تکثیر توسط آزمایشگاههای تحقیقاتی مستقل، همراه با در دسترس بودن بیوراکتورهای تجاری برای تحریک الکترومکانیکی، در دسترس بودن کاردیومیوسیتهای بالغ راهی روشن برای چاپ سه بعدی بیولوژیکی قلب انسان برای پیوند بالینی فراهم میکند .علاوه بر بلوغ کاردیومیوسیتهای مشتق از iPS ، چالش های زیادی نیز وجود دارد.
تبدیل سلولهای iPS به کاردیومیوسیت ها یک مهارت بسیار تخصصی است و به کادر فنی آموزش دیده نیاز دارد. حفظ سلولهای iPS در مرحلهای پرقدرت همچنان چالش برانگیز است. هزینه بالایی در ارتباط با تولید کاردیومیوسیتهای مشتق از iPSاست، به دلیل هزینه واکنش دهندههای مرتبط و همچنین به دلیل سطح آموزش مورد نیاز کارکنان تحقیق. علاوه بر این، در حال حاضر چالش هایی در تولید تعداد بسیار زیادی از کاردیومیوسیتهای مشتق از iPS برای چاپ زیستی قلب انسان وجود دارد.
پیشرفت چاپ سه بعدی زیستی
پیشرفتهای اخیر در زمینه چاپ زیستی سه بعدی، مسیری روشن برای آینده فراهم کرده است که نشان می دهد چاپ زیستی بالقوه فوق العادهای در توسعه اندامهای عملکردی برای پیوند بالینی دارد. در حالی که هنوز چالشهایی در این زمینه از دیدگاه علمی و تکنولوژیکی وجود دارد، چالشهای مربوط به عوامل نظارتی نیز وجود دارد.
بسیاری از چالشهای مربوط به مسائل نظارتی در چاپ زیستی سه بعدی همانند رشته مهندسی بافت به طور کلی است و تا حدودی مبهم است. این امر به عدم موفقیت تجاری در مقیاس بزرگ در زمینه مهندسی بافت به طور گسترده و چاپ زیستی سه بعدی به طور خاص نسبت داده شده است. با بالغ شدن زمینه برای دستیابی به موفقیتهای تجاری، پیشرفتهای موازی در روند نظارتی با وضوح بیشتر در حوزه وجود خواهد داشت.
>> بیشتر بدانید: ادغام دنیای مجازی(VR) و دنیای واقعی با چاپگر سه بعدی
چاپ زیستی چهار بعدی
علاوه بر این ، معرفی چاپ زیستی 4 بعدی مورد توجه قرار گرفته است. این مفهومی است که از چاپ زیستی سه بعدی برای ایجاد یک محصول اولیه استفاده می کند که می تواند به مرور زمان به شکل نهایی خود مانور دهد. به عنوان مثال، مواد قالب پذیر را می توان در یک ساختار اولیه با چاپ زیستی سه بعدی ادغام کرد و متعاقبًاً برای ایجاد شکل، دوام و عملکرد مطلوب برای یک هدف خاص، دستکاری کرد. اگرچه کاربردهای عملی چاپ زیستی 4 بعدی در حال بررسی است، اما این پتانسیل را دارد که ابزارهای موجود برای ساخت ساختارهای پیچیده ای را که از بافتهای طبیعی تقلید می کنند، گسترش دهد.
فناوری چاپ زیستی به سمت توسعه سازه های قلبی قابل درمان برای مدیریت MI و عوارض مرتبط پیش می رود. با این حال، حوزه چاپ زیستی قلب هنوز در مراحل اولیه خود است و تحقیقات بیشتری لازم است تا یافته های آزمایشگاهی دلگرم کننده را به عرصه بالینی ترجمه کند.
بحث و نتیجه گیری
مزیت اصلی چاپ بیولوژیکی بافت قلبی سه بعدی، بهبود عملکرد قلب بدون نیاز به کاشت اهدا کننده است. پیشرفتهای مستمر در روش های چاپ زیستی می تواند منجر به بهبود عملکرد و عملکرد in vivo سازه های بافت قلب شود . رویکردهایی مانند تزریق هیدروژلهای مشتق شده از ECM به بافت آسیب دیده قلب در بهبود عملکرد پس از ایسکمی یا MI موثر بوده است.
فناوری چاپ زیستی سه بعدی هنوز تأثیر قابل توجهی در زمینه قلب شناسی بالینی ایجاد نکرده است و آزمایشات بالینی در مورد آن محدود است. نکته قابل توجه این است که در آزمایش بالینی اخیر برای VentriGel ، هیدروژل ECM قلب ، 15 بیمار مبتلا به اختلال عملکرد متوسط بطن چپ حداکثر 18 تزریق به سکته و مناطق مرزی اطراف دریافت کردند. بیمارانی که پس از سکته قلبی تحت درمان قرار گرفتند، پس از یک سال در بازسازی بطن چپ بهبود یافتند و همه بیماران در کلاس عملکردی انجمن قلب نیویورکNYHA کاهش یافتند. اگرچه مطالعات بیشتری برای ارزیابی اثر VentriGel مورد نیاز است، اما نتایج این مطالعه بی سابقه مزایای بالقوه چاپ زیستی سه بعدی قلب را روشن می کند.
علاوه بر این، چاپ زیستی سه بعدی قلب فرصتهای امیدوارکننده ای برای ریز الگوی داربست و همچنین سیستم های بدون داربست برای بازآفرینی معماری بافت شناسی بافت قلبی بومی ارائه می دهد. شاید چاپ بافتهای سفارشی با توجه به نوع بیمار انجام شود زیرا آناتومی منحصر به فرد می تواند اثرات مفید قلب شناسی احیا کننده را افزایش دهد.

<< 3dRD بزرگترین و تخصصی ترین تولید کننده پرینتر های سه بعدی در ایران >>
انتشار مقاله:
دومین کنفرانس بین المللی مطالعات میان رشته ای علوم بهداشتی، روانشناسی، مدیریت و علوم تربیتی | مونترال – کانادا
منابع:
1-10
1- Gu Z, Fu, J., Lin, H., He, Y. Development of 3D bioprinting: from printing methods to biomedical applications. Asian J Pharm Sci. 2019. https://doi.org/10.1016/j.ajps.2019.11.003.
2- Alonzo M, AnilKumar S, Roman B, et al. 3D Bioprinting of cardiac tissue and cardiac stem cell therapy. Transl Res. 2019;211:64–83. https://doi.org/10.1016/j.trsl.2019.04.004.
3-Zhang X, Zhang Y. Tissue engineering applications of three- dimensional bioprinting. Cell Biochem Biophys. 2015;72:777–82. https://doi.org/10.1007/s12013-015-0531-x.
4- Mandrycky C, Wang Z, Kim K, et al. 3D bioprinting for engi- neering complex tissues. Biotechnol Adv. 2016;34:422–34. https://doi.org/10.1016/j.biotechadv.2015.12.011.
5- P. Kulkarni, D. Dutta, An accurate slicing procedure for layered manufacturing, Comput. Aided Des. 28 (1996) 683–697, https://doi.org/10.1016/0010-4485 (95)00083-6.
6- P. Mohan Pandey, N. Venkata Reddy, S.G. Dhande, Slicing procedures in layered manufacturing: a review, Rapid Prototyp. J. 9 (2003) 274–288, https://doi.org/ 10.1108/13552540310502185.
7- ISO/ASTM, 52900-15, Standard Terminology for Additive Manufacturing – General Principles – Te
8- J. Groll, T. Boland, T. Blunk, J.A. Burdick, D.-W. Cho, P.D. Dalton, B. Derby, G. Forgacs, Q. Li, V.A. Mironov, L. Moroni, M. Nakamura, W. Shu, S. Takeuchi, G. Vozzi, T.B.F. Woodfield, T.Xu, J.J. Yoo, J. Malda. Biofabrication, 8 (2016), Article 013001, 10.1088/1758-5090/8/1/013001
9-K. Hölzl, S. Lin, L. Tytgat, S. Van Vlierberghe, L. Gu, A. Ovsianikov Bioink properties before, during and after 3D bioprinting Biofabrication, 8 (2016), Article 032002, 10.1088/1758-5090/8/3/032002
10- Y. Nishiyama, M. Nakamura, C. Henmi, K. Yamaguchi, S. Mochizuki, H. Nakagawa, K. TakiuraDevelopment of a three-dimensional bioprinter: construction of cell supporting structures using hydrogel and state-of-the-art inkjet technology J. Biomech. Eng., 131 (2009), Article 035001, 10.1115/1.3002759
11-20
11-L. Koch, M. Gruene, C. Unger, B. Chichkv Laser assisted cell printing Curr. Pharm. Biotechnol., 14 (2013), pp. 91-97
12- -T. Andersen, P. Auk-Emblem, M. Dornish 3D cell culture in alginate hydrogels Microarrays (Basel), 4 (2015), pp. 133-161, 10.3390/microarrays4020133
13- T. Andersen, P. Auk-Emblem, M. Dornish 3D cell culture in alginate hydrogel Microarrays (Basel), 4 (2015), pp. 133-161, 10.3390/microarrays4020133
14-C. Colosi, M. Costantini, A. Barbetta, M. Dentini Microfluidic bioprinting of heterogeneous 3D tissue constructs
15- K. Tappa, U. Jammalamadaka, Novel biomaterials used in medical 3D printing techniques, J. Funct. Biomater. 9 (1) (2018) 17.
16- J.-.H. Shim, et al., Effects of 3D-printed polycaprolactone/𝛽-tricalcium phosphate membranes on guided bone regeneration, Int. J. Mol. Sci. 18 (5) (2017) 899.
17- L. Dong, S.-.J. Wang, X.-.R. Zhao, Y.-.F. Zhu, J.-.K. Yu, 3D-printed poly (𝜀-caprolactone) scaffold integrated with cell-laden chitosan hydrogels for bone tissue engineering, Sci. Rep. 7 (1) (2017) 1–9.
18- J.A. Weisman, J.C. Nicholson, K. Tappa, U. Jammalamadaka, C.G. Wilson, D.K. Mills, Antibiotic and chemotherapeutic enhanced three-dimensional printer filaments and constructs for biomedical applications, Int. J. Nanomed. 10 (2015) 357.
19- R. Birla, Introduction to Tissue Engineering: Applications and Challenges (Wiley-IEEE Press, 2014). p.360.
20- J. Paez-Mayorga, G. Hernandez-Vargas, G. U. Ruiz-Esparza, H. M. N. Iqbal, X. Wang, Y. S. Zhang, R. Parra-Saldivar, and A. Khademhosseini, “Bioreactors for cardiac tissue engineering,” Adv. Healthcare Mater.8(7), e1701504 (2019).
21-30
21- B.Docherty, “The heart: Part one—The anatomy,” Nurs. Times 101(30), 28–29 (2005).
23-S.Mori, D. E. Spicer, and R. H. Anderson, “Revisiting the anatomy of the living heart,” Circ. J. 80(1), 24–33 (2016).
22J. A.Birkeland, O. M. Sejersted, T. Taraldsen, and I. Sjaastad, “EC-coupling in normal and failing hearts,” Scand. Cardiovasc. J. 39(1–2), 13–23 (2005).
23N. Noor, A. Shapira, R. Edri, I. Gal, L. Wertheim, and T. Dvir, “3D printing of personalized thick and perfusable cardiac patches and hearts,” Adv. Sci. 6(11), 1900344 (2019).
24- K. Maass, A. Shekhar, J. Lu, G. Kang, F. See, E. E. Kim, C. Delgado, S. Shen, L. Cohen, and G. I. Fishman, Stem Cells 33(4), 1102– 1112 (2015).
25B. A. Pallante, S. Giovannone, L. Fang-Yu, J. Zhang, N. Liu, G. Kang, W. Dun, P. A. Boyden, and G. I. Fishman, “Contactin-2 expression in the cardiac Purkinje fiber network,” Circ. Arrhythm Electrophysiol. 3(2), 186–194 (2010).
26- S. Y. Tsai, K. Maass, J. Lu, G. I. Fishman, S. Chen, and T. Evans, “Efficient generation of cardiac Purkinje cells from ESCs by activating cAMP signaling,” Stem Cell Rep. 4(6), 1089–1102 (2015)
27-G. Li, X. He, and C. Sun, Mol. Med. Rep. 11(1), 3–10 (2015
28- D. Jeziorowska, A. Korniat, J. E. Salem, K. Fish, J. S. Hulot, I.Karakikes, M.Ameen, V.Termglinchan, and J.C. Wu, Expert Opin. Biol. Ther. 15(10), 1399–1409 (2015).
29- I. Karakikes, M. Ameen, V. Termglinchan, and J. C. Wu, “Human induced pluripotent stem cell-derived cardiomyocytes: Insights into molecular, cellular, and functional phenotypes,” Circ. Res. 117(1), 80–88 (2015).
30- L. Zhang, J. Guo, P. Zhang, Q. Xiong, S. C. Wu, L. Xia, S. S. Roy, J. Tolar, T. D. O’Connell, M. Kyba, K. Liao, and J. Zhang, Circ.: Heart Failure 8(1), 156–166 (2015).
31-35
31B. Jiang, Z. Xiang, Z. Ai, H. Wang, Y. Li, W. Ji, and T. Li, “Generation of cardiac spheres from primate pluripotent stem cells in a small molecule-based 3D system,” Biomaterials 65, 103–114 (2015).
32R. Gaetani, P. A. Doevendans, C. H. Metz, J. Alblas, E. Messina, A. Giacomello, and J. P. Sluijter, “Cardiac tissue engineering using tissue printing technology and human cardiac progenitor cells,” Biomaterials 33(6), 1782–1790 (2012).
33-C. C. Chang, S. S. Nunes, S. C. Sibole, L. Krishnan, S. K. Williams, J. A. Weiss, and J. B. Hoying, “Angiogenesis in a microvascular construct for transplantation depends on the method of chamber circulation,” Tissue Eng., Part A 16(3), 795–805 (2009).
34- T. Shin’oka, G. Matsumura, N. Hibino, Y. Naito, M. Watanabe, T. Konuma, T. Sakamoto, M. Nagatsu, and H. Kurosawa, “Midterm clinical result of tissueengineered vascular autografts seeded with autologous bone marrow cells,” J. Thorac. Cardiovasc. Surg. 129(6), 1330–1338 (2005).
35-M. Mathur, P. Patil, and A. Bove, “The role of 3D printing in structural heart disease: All that glitters is not gold,” JACC Cardiovasc. Imaging 8(8), 987–988 (2015).
دانلود PDF این مطلب: Download Bio 3D printing: Heart











